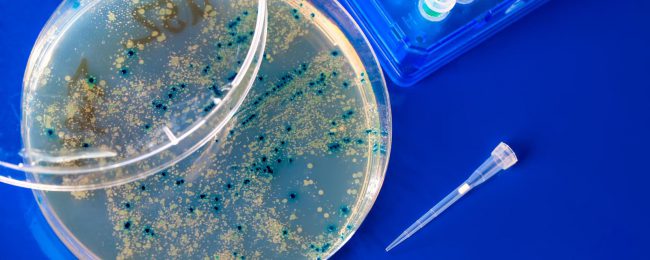
В начале 1890-х годов Эрнест Ханкин изучал вспышки холеры возле берегов Ганга. Местные жители сбрасывали мертвых в воды священной реки, а река в ответ становилась ядовитым источником болезни, и эпидемия буйствовала в городах и деревнях вниз по речной долине. Он видел это по всей Европе, когда запасы воды оказывались зараженными бактериями, но здесь, на берегах Ганга, заболевание как-то удавалось сдерживать; новые вспышки затухали, а затем и вовсе исчезали, а не распространялись как лесной пожар.
Ханкин решил, что в воде было нечто таинственное, что убивало бактерий до того, как они начинали сеять хаос, но потребовалось еще 20 лет, чтобы французский ученый догадался, что ангелом-хранителем Ганга выступал вирус-бактериофаг. Безвредный для людей, но смертельно опасный для холерных бактерий, этот вирус очищал воду, прежде чем она могла заразить местных купальщиков.
Долгое время ученые игнорировали эти «вирусы-ниндзя». Но теперь они полагают, что однажды эти вирусы спасут миллионы жизней, далеко за пределами берегов Ганга, поскольку предлагают нам новый арсенал оружия против смертельной болезни.

Новый подход к лечению инфекции появится не скоро. На протяжении десятилетий мы полагались на антибиотики вроде пенициллина. Если вы не очень юны, стары или физически слабы, вам не придется бояться царапин, ушибов или обычных операций. Но по мере распространения антибиотиков бактерии начали обзаводиться защитными механизмами против этих лекарств — и последствия становятся все более тревожными.
Сегодня «антибиотик-резистентные», или просто устойчивые к антибиотикам, бактерии уже отнимают несколько сотен тысяч жизней в год — но это число может вырасти до 10 миллионов к 2050 году, согласно отчетам правительства Великобритании за 2014 год.
«Это число людей, которые умирают от рака сегодня, и это не просто пожилые люди — это может быть кто угодно. Тривиальные травмы вроде царапин или основных видов медицинской помощи — родов или операций на бедре — могут потенциально подвергнуть нас этим типам устойчивых к антибиотикам инфекций», говорит Хезер Хендриксон из Университета Мэсси в Окленде, Новая Зеландия. «Нас затягивает в ту доантибиотическую эпоху, когда продолжительность жизни была короче, потому что мы не могли бороться с инфекцией».
Если мы хотим избежать этого безрадостного видения будущего, нам нужно радикальное решение — и Хендриксон думает, что мы должны пересмотреть свое отношение к бактериофагам, которые спасали жителей берегов Ганга.
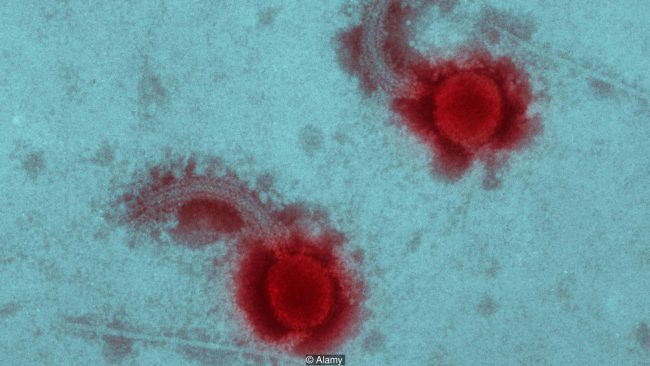
По сравнению с более развитыми организмами, бактериофаг удивительно скромный: небольшой пучок белка, который может проникнуть в бактерию и взять под контроль ее машинное отделение, чтобы создать сотни дополнительных копий себя, которые затем взорвутся в умирающей клетке бактерии. Человеческое тело уже использует этот процесс как естественную защиту — в наших носах полно бактериофагов, которые могут убивать бактерии в воздухе, которым мы дышим.
Есть много причин, почему бактериофаги могут быть многообещающей линией атаки для врачей, которые надеются побороть устойчивость к антибиотикам. Их много больше, чем бактерий, например: Хендриксон отмечает, что вирусы-бактериофаги превосходят бактерии в числе десятикратно. В каждом грамме почвы больше бактериофагов, чем людей на планете.
Что еще более примечательно, вирусы-ниндзя поражают только конкретные цели. Это важно, поскольку врачи считают, что микробиом нашего тела может иметь важное значение для нашего здоровья, защищать нас от астмы и, может быть, даже балансировать производство наших нейромедиаторов для хорошего психического состояния.
Антибиотики не особо разборчивы и могут уничтожить дружественных нам бактерий перекрестным огнем. Они поражают наши тела как ядерная бомба, в то время как бактериофаги могли бы выступать в роли обученных снайперов, снимая лишь вредоносные цели, оставляя дружественные нетронутыми.
Разнообразие бактериофагов в сочетании с их индивидуальной спецификой может предложить большой потенциал для новых методов лечения. Но для ученых вроде Хендриксон это будет серьезной работой, поскольку придется выделить профиль каждого бактериофага и определить конкретные источники инфекции, которую они могут вылечить. Придется завести гигантскую библиотеку возможных терапевтических средств.
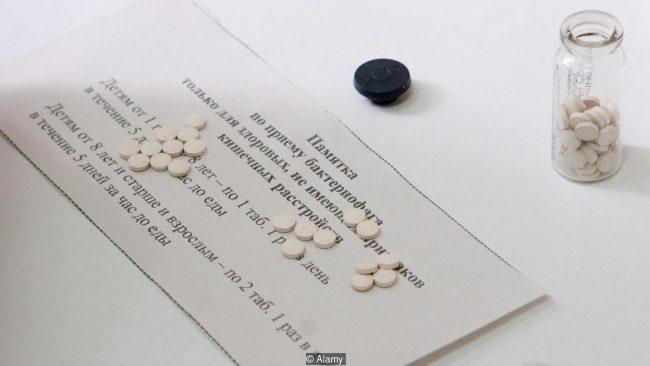
В настоящее время Хендриксон работает со своими учениками над картированием бактериофагов, которые обнаруживаются обычно в почве. После того как они начали работать над библиотекой бактериофагов, им также понадобится найти безопасные и надежные способы выращивания, очистки и хранения бактериофагов — и им придется проверить, не несет ли лечение с их участием побочных эффектов. При этом бактериофаги имеют свойство быть весьма хрупкими и легко разрушаются с течением времени. Возможно, они будут провоцировать иммунный ответ, вызывая нежелательные аллергические реакции.
Пока что исследованием бактериофагов по большей части занимаются страны Восточной Европы; многие продолжали исследовать бактериофагов после того, как Запад обратился к антибиотикам. За железным занавесом, Грузия, Россия и Польша использовали бактериофагов как лекарство на протяжении всего этого времени. Зачастую их использовали и для полевой медицины.
Очевидно, эти исследования не увидели свет в медицинских журналах на английском языке и оставались скрытыми от многих ученых на Западе. Эту проблему хочет решить Хендриксон при помощь новых сотрудничеств.
Одно из первых крупных клинических испытаний на Западе будет заключаться в использовании бинтов, пропитанных бактериофагами, чтобы увидеть, могут ли они предотвратить заражение пострадавших от ожогов. Возможно, этот путь в медицине действительно спасет нас от апокалипсиса без антибиотиков.